出国留学网专题频道高考化学知识点栏目,提供与高考化学知识点相关的所有资讯,希望我们所做的能让您感到满意!
高考化学必考的理论知识有哪些?需要了解的考生看过来,下面由出国留学网小编为你精心准备了“高考化学必考知识点有哪些”仅供参考,持续关注本站将可以持续获取更多的内容!
1、氧化还原相关概念和应用
(1)借用熟悉的H2还原CuO来认识5对相应概念。
(2)氧化性、还原性的相互比较。
(3)氧化还原方程式的书写及配平。
(4)同种元素变价的氧化还原反应(歧化、归中反应)。
(5)一些特殊价态的微粒如H、Cu、Cl、Fe、S2O32–的氧化还原反应。
(6)电化学中的氧化还原反应。
2、物质结构、元素周期表的认识
(1)主族元素的阴离子、阳离子、核外电子排布。
(2)同周期、同主族原子的半径大小比较。
(3)电子式的正确书写、化学键的形成过程、化学键、分子结构和晶体结构。
(4)能画出短周期元素周期表的草表,理解“位—构—性”。
3、熟悉阿伏加德罗常数NA常考查的微粒数止中固体、得失电子、中子数等内容。
4、热化学方程式的正确表达(状态、计量数、能量关系)
5、离子的鉴别、离子共存
(1)离子因结合生成沉淀、气体、难电离的弱电解质面不能大量共存。
(2)因相互发生氧化还原而不能大量共存。
(3)因双水解、生成络合物而不能大量共存。
(4)弱酸的酸式酸根离子不能与强酸、强碱大量共存。
(5)题设中的其它条件:“酸碱性、颜色”等。
6、溶液浓度、离子浓度的比较及计算
(1)善用微粒的守恒判断(电荷守衡、物料守衡、质子守衡)。
(2)电荷守恒中的多价态离子处理。
7、pH值的计算
(1)遵循定义(公式)规范自己的计算过程。
(2)理清题设所问的是“离子”还是“溶液”的浓度。
(3)酸过量或碱过量时pH的计算(酸时以H+浓度计算,碱时以OH–计算再换算)。
8、化学反应速率、化学平衡
(1)能计算反应速率、理解各物质计量数与反应速率的关系。
(2)理顺“反应速率”的“改变”与“平衡移动”的“辩证关系”。
(3)遵循反应方程式规范自己的“化学平衡”相关计算过程。
(4)利用等效平衡”观点来解题。
9、电化学
(1)能正确表明“原电池、电解池、电镀池”及变形装置的电极位置。
(2)能写出各电极的电极反应方程式。
(3)了解常见离子的电化学放电顺序。
(4)能准确利用“得失电子守恒”原则计算电化学中的定量关系。
10、盐类的水解
(1)盐类能发生水解的原因。
(2)不同类型之盐类发生水解的后果(酸碱性、浓度大小等)。
(3)盐类水解的应用或防止(胶体、水净化、溶液制备)。
(4)对能发生水解的盐类溶液加热蒸干、灼烧的后果。
(5)能发生完全双水解的离子反应...
高考频道为大家提供高考化学思维导图:化学计量在实验中的应用,一起来学习一下吧!更多高考资讯请关注我们网站的更新!
高考化学思维导图:化学计量在实验中的应用
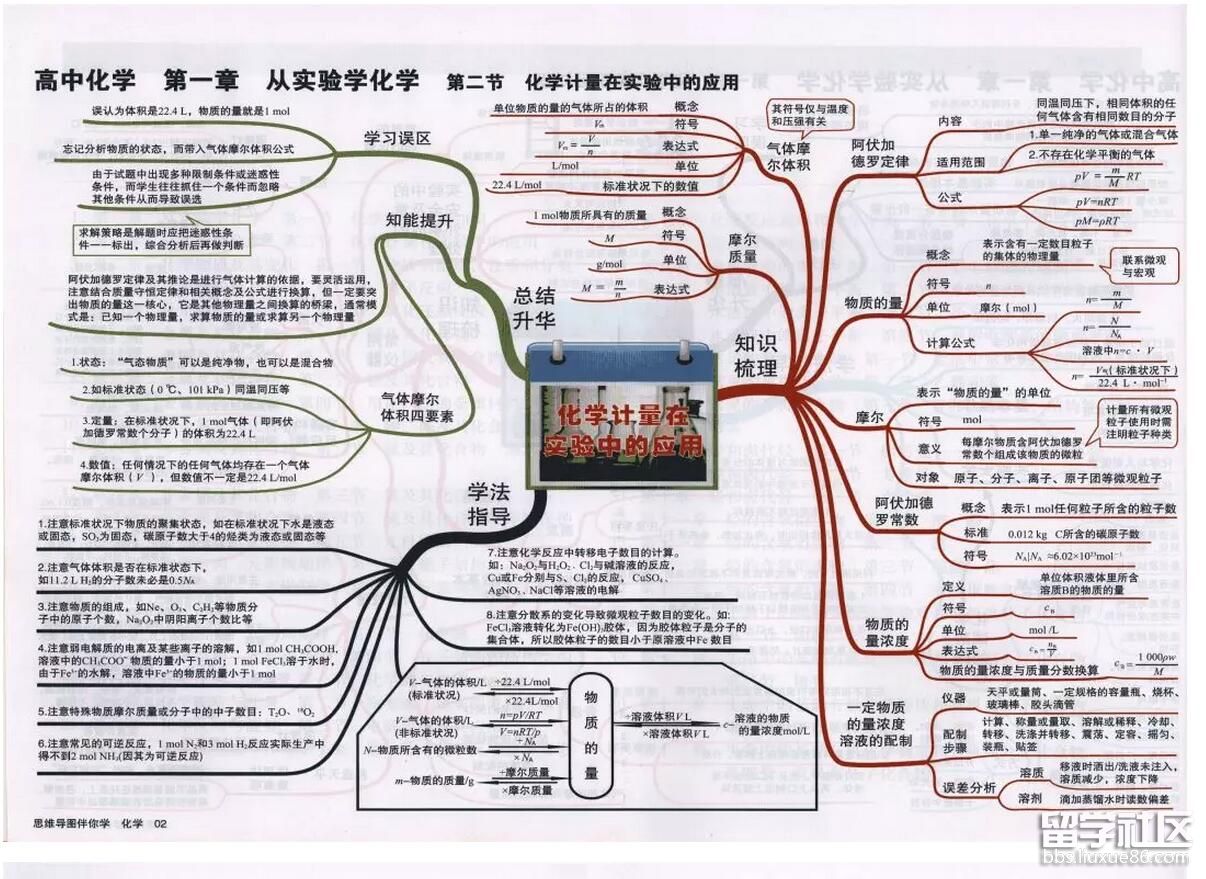
小编精心为您推荐:
高考频道为大家提供高考化学思维导图:化学实验基础知识,一起来看看吧!更多高考资讯请关注我们网站的更新!
高考化学思维导图:化学实验基础知识
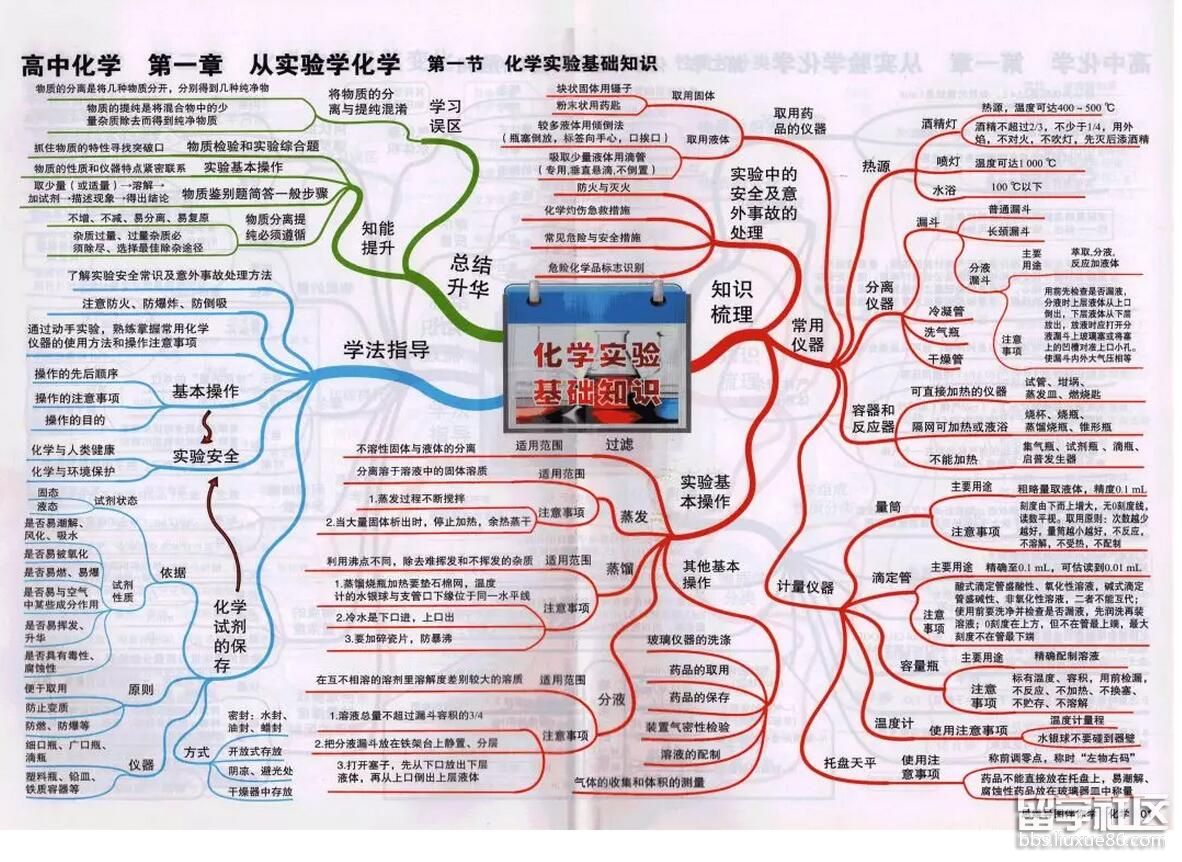
小编精心为您推荐:
高考频道为大家提供2019高考化学考点复习:硅和二氧化硅,一起来复习一下吧!更多高考资讯请关注我们网站的更新!
2019高考化学考点复习:硅和二氧化硅
考点:硅和二氧化硅
相关考题 第四届世界互联网大会2017年12月3日上午在浙江省乌镇开幕。光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是( )
A、硫
B、二氧化硅
C、铁
D、氧化铝
【分析】 光导纤维的主要成分为二氧化硅,以此来解答。
【解答】制造光导纤维的主要原料是二氧化硅,所以生产光导纤维的主要成分为二氧化硅,故选B。
【点评】 本题考查光导纤维,明确二氧化硅的性质及用途即可解答。
小编精心为您推荐:
高考理综频道为大家提供2019高考化学16类高频考点,一起来复习一下吧!更多高考资讯请关注我们网站的更新!
2019高考化学16类高频考点
【1】氧化物的分类
1.氧化物的分类:
成盐氧化物:
酸性氧化物、碱性氧化物、两性氧化物、复杂氧化物(过氧化物、超氧化物、Fe3O4、Pb3O4等);
不成盐氧化物:
CO、NO
2.易混淆概念分辨
酸酐不一定是酸性氧化物:如乙酸酐酐(CH3CO)2O等;酸性氧化物一定是酸酐。
非金属氧化物不一定是酸性氧化物:如NO、CO、NO2、N2O4、H2O
酸性氧化物不一定是非金属氧化物:如Mn2O7、CrO3
金属氧化物不一定是碱性氧化物:如Al2O3、ZnO(两性),Mn2O7、CrO3(酸性氧化物)
碱性氧化物一定是金属氧化物
※NO2因与碱反应不仅生成盐和水,还有NO,因而不是酸性氧化物。
※Na2O2因与酸反应不仅生成盐和水,还有O2,因而不是碱性氧化物。
【2】具有漂白作用的物质
氧化作用:Cl2、O3、Na2O2、浓HNO3;化学变化;不可逆
化合作用:SO2;化学变化;可逆
吸附作用:活性炭;物理变化;可逆
※其中能氧化指示剂而使指示剂褪色的主要有Cl2(HClO)和浓HNO3及Na2O2
【3】能被活性炭吸附的物质
1、有毒气体(NO2、Cl2、NO等)——去毒;
2、色素——漂白;
3、水中有臭味的物质——净化。
【4】“黑色金属”有哪些
化学上把铁、铬、锰三种金属和铁基合金统称为“黑色金属”。
【5】Fe2+与Fe3+的鉴别方法
Fe2+与Fe3+的性质不同而又可以相互转化。中学化学中可用以下几种方法加以鉴别。
1.观察法:
其溶液呈棕黄色者是Fe3+,呈浅绿色者是Fe2+。
2.H2S法:
通往H2S气体或加入氢硫酸,有浅黄色沉淀析出者是Fe3+,而Fe2+溶液不反应。
2Fe3++H2S==2Fe2++2H++S↓
3.KSCN法:
加入KSCN或其它可溶性硫氰化物溶液,呈血红色者是Fe3+溶液,而Fe2+的溶液无此现象。这是鉴别鉴别Fe3+与Fe2+最常用、最灵敏的方法。
Fe3++SCN==[Fe(SCN)]2+
4.苯酚法:
分别加入苯酚溶液,显透明紫色的是Fe3+溶液,无此现象的是Fe2+的溶液。
Fe3++6C6H5OH→[Fe(C6H5O)6]3+6H+(了解)
5.碱液法:
取两种溶液分别通入氨气或碱液,生成红褐色沉淀的是Fe3+溶液,生成白色沉淀并迅速变为灰绿色、最终变成红褐色的是Fe2+溶液。Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+;
Fe3++3OH==Fe(OH)3↓
Fe2++2...
高考理综频道为大家提供高考化学知识点归纳:化学键,一起来复习一下吧!更多高考资讯请关注我们网站的更新!
高考化学知识点归纳:化学键
(1)当一个化合物中只存在离子键时,该化合物是离子化合物
(2)当一个化合物中同时存在离子键和共价键时,以离子键为主,该化合物也称为离子化合物(3)只有当化合物中只存在共价键时,该化合物才称为共价化合物。..
(4)离子化合物中不一定含金属元素,如NH4NO3,是离子化合物,但全部由非金属元素组成。(5)含金属元素的化合物不一定是离子化合物,如A1C13、BeCl2等是共价化合物。例如:化学键与物质类别的关系
化学键知识点:用电子式表示化学反应的实质:
(1)用电子式表示离子化合物的形成过程:
(2)用电子式表示共价化合物的形成过程:
说明:用电子式表示化合物的形成过程时要注意:
(1)反应物要用原子的电子式表示,而不是用分子或分子的电子式表示。用弯箭头表示电子的转移情况,而共价化合物不能标。
(2)这种表示化学键形成过程的式子,类似于化学方程式,因此,它要符合质量守恒定律。但是,用于连接反应物和生成物的符号,一般用“→”而不用“=”。
化学键知识点:化学键与物质变化的关系
1.与化学变化的关系
化学反应实质是旧化学键的断裂和新化学键的形成。任何反应都必然发生化学键的断裂和形成。
2.与物理变化的关系
发生物理变化的标志是没有生成新物质可能伴随着化学键的断裂,但不会有新化学键的形成。物理变化的发生也可能没有化学键的断裂,只是破坏了分子之间的氢键或范德华力如冰的融化和干冰的气化。
来源:育路教育网
小编精心为您推荐:
本网站高考频道带来了高考化学必知判断知识:特征形象,供你复习参考。更多相关资讯请关注本网站更新。
高考化学必知判断知识:特征形象
1. 焰色反应:Na+(黄色)、K+(紫色)
2. 浅黄色固体:S或Na2O2或AgBr或FeS2
3. 有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、 (紫色)
4.有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3] 、蓝色[Cu(OH)2]、黑色(CuO、FeO、FeS、CuS、Ag2S、PbS) 、黄色(AgI、 Ag3PO4)、白色[Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3]
5. 气体:Cl2(黄绿色)、NO2(红棕色)
6. 特征反应现象:Fe(OH)2→Fe(OH)3,白色到灰绿到红褐色
推荐阅读:
...
本网站高考频道为你收集了高考化学必知判断知识:化学性质与用途,希望能帮你顺利备考。更多相关资讯请关注本网站更新。
高考化学必知判断知识:化学性质与用途
1. F是单质与水反应最剧烈的非金属元素。
2. N是气态氢化物与其最高价氧化物对应水化物能起化合反应的元素。
3. S是气态氢化物与其低价氧化物能反应生成该元素的元素。
4. P是在空气中能自燃的元素。
5. F是气态氢化物的水溶液可以雕刻玻璃的元素。
6. O是有两种同素异形体对人类生存最为重要的元素。
7. Mg是既能在CO2中燃烧,又能在N2中燃烧的金属单质。
8. Li、Na、F的单质在常温下与水反应放出气体的短周期元素。
推荐阅读:
...
本网站小编为你收集了高考化学必知判断知识:含量与物理性质,希望能在化学复习中帮到你。更多相关资讯请关注本网站更新。
高考化学必知判断知识:含量与物理性质
1. O是地壳中质量分数最大的元素,Si次之,Al是地壳中质量分数最大的金属元素。
2. H是最轻的非金属元素;Li是最轻的金属元素。
3. Na是焰色反应为黄色的元素;K是焰色反应为紫 色(透过蓝色的钴玻璃观察)的元素。
4. Si是人工制得纯度最高的元素;C是天然物质中硬度最大的元素。
5. N是气态氢化物最易溶于水的元素;O是氢化物沸点最高的非金属元素。
6. 常温下,F、Cl是单质具有有色气体的元素。
7. C是形成化合物种类最多的、最高价氧化物的含量增加会导致“温室效应”的元素。
8. Cl是单质最易液化的气体、最高价氧化物的 水化物酸性最强的元素。
推荐阅读:
...
本网站为你收集了高考化学必知判断知识:位置与结构,希望能帮你顺利备考。更多相关资讯请关注本网站更新。
高考化学必知判断知识:位置与结构
1. Li是周期序数等于族序数2倍的元素。
2. S是最高正价等于最低负价绝对值3倍的元素。
3. Be、Mg是最外层电子数与最内层电子数相等的元素;
4. Li、Na是最外层电子数是最内电子数的1/2的元素;
5. 最外层电子数是最内层电子数的2倍的是C、Si;3倍的是O、S;4倍的是Ne、Ar。
6. Be、Ar是次外层电子数等于最外层电子数的元素;
7. Na是次外层电子数等于最外层电子数8倍的元素。
8. H、He、Al是原子最外层电子数与核外电子层数相等。
9. He、Ne各电子层上的电子数都满足2n2的元素。
10. H、He、Al是族序数与周期数相同的元素。
11. Mg是原子的最外层上的电子数等于电子总数的1/6的元素;
12. 最外层上的电子数等于电子总数的1/3的是Li、P;1/2的有Be;相等的是H、He。
13. C、S是族序数是周期数2倍的元素。
14. O是族序数是周期数3倍的元素。
15. C、Si是最高正价与最低负价代数和为零的短周期元素。
16. O、F是最高正价不等于族序数的元素。
17. 子核内无中子的原子 氢(H)
18. 形成化合物种类最多的元素 碳
19. 地壳中含量前三位的元素 O、Si、Al
20. 大气中含量最多的元素 N
21. 最外层电子数为次外层2倍的元素(或次外层电子数为最外层1/2的元素)C
22. 最外层电子数为次外层3倍的元素(或次外层电子数为最外层1/3的元素) O
23. 最外层电子数为次外层4倍的元素(或次外层电子数为最外层1/4的元素)Ne
24. 最外层电子数为次外层电子数1/2的元素Li、Si
25. 最外层电子数为次外层电子数1/4的元素 Mg
26. 最外层电子数比次外层电子数多5个的元素 F
27. 最外层电子数比次外层电子数少3个的元素P
28. 最外层电子数比次外层电子数多5个的元素 Al
29. 核外电子总数与其最外层电子数之比为3:2的元素C
30. 内层电子总数是最外层电子数2倍的原子有Li 、P
31. 电子层数跟最外层电子数数相等的原子有H 、Be、 Al
32. 核外电子总数与其最外层电子数之比为4:3的元素 O
33. 最外层电子数是电子层数2倍的原子有关He、 C、 S
34. 最外层电子数跟次外层电子数相等的原子有Be、Ar
35. X、Y两元素可形成X2Y和X2Y2两种化合物(或形成原子个数比2:1与1:1的化合物 Na2O、Na2O2 、H2O、H2O2
推荐阅读:
高考化学知识点推荐访问