出国留学网专题频道无机化学栏目,提供与无机化学相关的所有资讯,希望我们所做的能让您感到满意! 无机化学相对于有机化学,研究非含碳化合物。然而某些含碳化合物,如:一氧化碳、二氧化碳、二硫化碳、碳酸类化合物、氰化物等等仍属于无机化学讲述的范畴。这是因为这些化合物并不是由碳链或碳原子所构成的环组成,因而与一般有机化合物的性质有很大的不同。在现代由于化学知识的进步,有机化学与无机化学两个领域之间也有越来越多的重叠,举例来说,有机金属便是有机化学与无机化学的交叉处。
03-06
考研复试备考除了复习,考研调剂也是需要重点关注的。下面由出国留学网小编为你精心准备了“2020长春工业大学无机化学专业的调剂信息”,持续关注本站将可以持续获取更多的考试资讯!
2020长春工业大学无机化学专业的调剂信息
一、考研调剂招生信息
| 学校: | 长春工业大学 |
| 专业: | 理学->化学->无机化学 |
| 年级: |
02-19
复试即将开始,备考准备不足的考生赶紧看过来,下面由出国留学网小编为你精心准备了“北京化工大学2020无机化学考研复试参考书目2.19”,持续关注本站将可以持续获取更多的考研资讯!
无机化学 | 材料学院高精尖中心 |
02-19
考研复试公告已经出现,还不知道的考生赶紧看过来,下面由出国留学网小编为你精心准备了“北京化工大学2020无机化学考研复试参考书目”,持续关注本站将可以持续获取更多的考研资讯!
综合四(操作系统、数据库原理、 | 信息学院 |
04-03
今天小编为大家提供公务员公共基础自然科技知识:无机化学中的碳及其化合物,一起来学习一下相关知识点,做点练习题吧!
一、无机化学中的碳及其化合物知识点
1.碳的同素异形体
金刚石是无色透明晶体,是目前在地球上发现的最坚硬的物质,不导电,是钻石的原身。钻石的质量单位是克拉,1克拉等于200毫克。
石墨是灰黑色不透明固体,可以在高温、高压下形成人造金刚石。石墨比金刚石稳定。
2.一氧化碳和二氧化碳
一氧化碳是无色、无味、剧毒气体。一氧化碳极易与血红蛋白结合,造成组织窒息,严重时会致人死亡。
二氧化碳是无色无味气体,固体二氧化碳(CO2)俗称“干冰”,常作制冷剂。
二、无机化学中的碳及其化合物练习题
下列有关碳及其化合物的说法正确的是______.
A.二氧化碳是导致酸雨的主要气体
B.含碳燃料不完全燃烧会生成一氧化碳,一氧化碳有毒
C.液态二氧化碳灭火是因为气化时吸热,降低了可燃物的着火点.
解析:C
一、有机化学中的有机化合物和碳水化合物知识点
(一)有机化合物
有机化合物主要是指含有碳元素的化合物,但不是所有的含碳化合物都属于有机化合物,如一氧化碳(CO)、二氧化碳(CO2)、碳酸盐以及金属碳化物等均不属于有机化合物。
(二)碳水化合物
碳水化合物是自然界存在最多、分布最广的有机化合物。其特征如下:
(1)碳水化合物一般由碳、氢、氧三种元素组成,由于其所含的氢氧比为2:1,和水一样,故被称为“碳水化合物”。
(2)碳水化合物的功能主要是为人体储存和提供能量。
(3)碳水化合物分单糖、二糖、低聚糖、多糖四类。食物中的碳水化合物,分为人可以吸收利用的有效碳水化合物(单糖、多糖等)和人不能消化的无效碳水化合物(纤维素)两大类。
二、有机化学中的有机化合物和碳水化合物练习题
下列属于碳水化合物的是[ ]
A、蛋白质
B、纤维素
C、油脂
D、淀粉
【解析】BD
小编精心为您推荐:
04-03
磷的同素异形体有哪些,它们有什么特征?小编为大家提供公务员公共基础自然科技知识:无机化学中的磷及其化合物,一起来复习一下吧!
磷的同素异形体:黑磷、白磷、红磷。
其中白磷与红磷的比较如下:
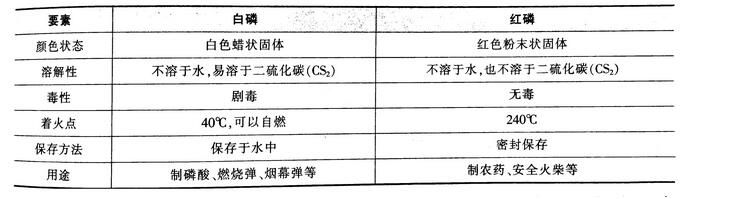
磷的重要氧化物为五氧化二磷(P2O5),其为白色雪花状固体,吸湿性强,是常用的干燥剂和吸水剂,但不能用来干燥氨气(NH3)。五氧化二磷是磷酸的酸酐,可与水形成磷酸。
氮气是无色、无味的气体,比空气略轻,难溶于水,化学性质不活泼。
一氧化氮(NO)是一种无色、无味、不溶于水的有毒气体,能与血红蛋白作用引起中毒。
二氧化氮(NO2)是一种有刺激性气味、有毒、有强氧化性的红棕色气体,易溶于水,能与水反应。
空气中的二氧化氮是造成光化学烟雾的主要因素,二氧化氮在紫外线照射下,会发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾,刺激呼吸器官,危害人体的健康。
小编精心为您推荐:
<...
考研大纲频道为大家提供华侨大学2019考研大纲:820综合考试(无机化学+有机化学),一起来看看吧!更多考研资讯请关注我们网站的更新!
华侨大学2019考研大纲:820综合考试(无机化学+有机化学)
招生学院: 材料科学与工程学院 招生专业: 材料科学与工程
科目名称: 综合考试(无机化学+有机化学)
一、考试形式与试卷结构
(一)试卷满分值及考试时间
本试卷满分为150分,考试时间为180分钟。
(二)答题方式
答题方式为闭卷、笔试。试卷由试题和答题纸组成;答案必须写在答题纸(由考点提供)相应的位置上。
(三)试卷内容结构
无机化学考试内容主要包括化学反应的基础理论(25%)、物质的形态与结构(15%)及元素性质(主要是过渡元素的性质)部分(10%)。
有机化学考试内容主要包括有机化学的基本概念、基本规律、基本反应(25%)、结构和性质的关系(10%)、各类有机化合物的相互转化及其规律(15%)。
(四)试卷题型结构
1.选择题(50分),共25道;
2.填空题(30分),共6-8道;
3.简答题(30分),共5道;
4.计算题或合成题(40分),共3道。
二、考查目标
课程考试的目的在于全面系统地测试考生对无机化学的基本概念、基本理论、基本计算掌握情况及应用知识分析问题和解决问题的能力;测试学生对有机化学各项内容的掌握程度。要求学生对有机化学内容应有比较系统和全面的了解,认识有机物结构和性质的关系,熟悉各类有机化合物的相互转化及其规律,掌握有机化学的基本概念、基本规律、基本反应及其应用。具有综合运用所学知识分析问题及解决问题的能力。
三、考查范围或考试内容概要
(一)无机化学主要内容
1.物质的状态:理想气体状态方程,气体分压定律和分体积定律,气体分子运动论,液体的蒸气压、沸点和凝固点,溶液浓度的表示方法,稀溶液的依数性。
2.化学反应中的能量关系:热力学中常用的术语(体系,环境,状态,状态函数,过程),热力学第一定律;化学反应中的焓变(ΔH),化学反应的热效应,热化学方程式,标准摩尔反应焓变(ΔrHmӨ),标准摩尔生成焓(ΔfHmӨ),标准摩尔燃烧焓(ΔcHmӨ);盖斯定律;焓变与反应的自发性;吉布斯自由能(G),标准摩尔反应吉布斯自由能变(ΔrGmӨ),标准摩尔反应生成吉布斯能(ΔfGmӨ);熵(S),标准摩尔熵(SmӨ),化学反应标准摩尔熵变(ΔrSmӨ),ΔrGmӨ与ΔrHmӨ和ΔrSmӨ的关系,化学反应方向的判断。
3.化学反应速率和化学平衡:化学反应速率、影响化学反应速率的因素(浓度、温度、催化剂)。基元反应,质量作用定律,反应速率方程,反应级数。阿伦尼乌斯方程式,碰撞理论,活化能,活化分子,过渡态理论,活化能与反应速率的关系。平衡常数(实验平衡常数,标准平衡常数(KӨ)),多重平衡规则,KӨ与ΔrGmӨ的关系。浓度、压力、温度对化学平衡的影响,催化剂与化学平衡,平衡移动总...
09-30
考研大纲频道为大家提供牡丹江师范学院2019考研大纲:810无机化学,一起来看看吧!更多考研资讯请关注我们网站的更新!
牡丹江师范学院2019考研大纲:810无机化学
科目代码、名称:810无机化学
专业类别:√学术型 √专业学位
适用专业: 无机化学、物理化学、学科教学(化学)
一、基本知识点
第1章 化学基础知识
(1)热力学的基本概念:系统和环境、气体、相、热力学温度、热与功、状态和过程、状态函数、热力学标准态。
第2章 化学热力学基础
(1)化学热力学的应用:盖斯定律及其应用,生成焓和生成自由能及其应用,利用焓变与熵变计算化学反应的标准摩尔自由能,吉布斯—赫姆霍兹公式;(2)判断化学反应进行方向的判据。
第3章 化学反应的速率
(1)反应机理、基元反应、复杂反应、反应级数、反应分子数的概念;
第4章 化学平衡
(1)化学反应的可逆性与化学平衡;(2)化学平衡的概念;(3)化学平衡移动原理。
第5章 原子结构与元素周期律
(1)核外电子排布原理和基态原子的电子组态(电子排布);(2)原子核外电子运动状态的描述:波函数和原子轨道,电子云,径向分布,角度分布四个量子数(3)原子结构与元素周期性的关系
第6章 分子结构和共价键理论
(1)分子轨道理论(2)杂化轨道理论 (3)共价键的形成和本质
第7章晶体结构
(1)分子的极性(2)离子的极化(3)金属的导电、导热性与延展性
第8章 酸碱电离平衡
(1)路易斯理论
第9章 沉淀溶解平衡
(1)沉淀溶解平衡:分步沉淀和沉淀的转化;(2)沉淀的生成与溶解;(3)溶度积与溶度积规则,
第10章 氧化还原反应
(1)自身的氧化还原反应;(2)元素化合价的升降;(3)氧化还原反应的基本概念,氧化数(4)氧化还原反应和电极电势
第11章 配位化合物
(1)过渡元素的价电子构型的特点及其元素通性的关系,第一过渡系元素的含氧酸盐和配合物性质;(2)配合物的基本概念;(3)影响配合物在溶液中稳定性的因素;(4)配合物命名原则及方法。
第12章 碱金属和碱土金属
(1)碱金属和碱土金属氢氧化物的溶解性、碱性及盐类溶解性、热稳定性的变化规律;(2)碱金属和碱土金属盐类的一些重要性质。(3)碱金属的存在、性质和制备;
第13章 硼族元素
(1)硼的两性与亲氧性、亲氟性;(2)硼化合物的缺电子性;(3)硼酸的特殊性;(4)铝单质及其化合物的性质。
第14章碳族元素
(1)碳族元素及其化合物性质变化规律;(2)硅单质及其化合物的性质;Pb及其化合物的性质及变化规律
第15章 氮族元素
(1)氮以及其的氢化物、氧化物、含氧酸和含氧酸盐的结构、性质、制备、鉴别和用途;(2)磷及其氢化物、氧化物、含氧酸和含氧酸盐的结构、性质、制备和用途;(3)砷的重要...
09-26
考研大纲频道为大家提供长沙理工大学2019考研大纲:833无机化学,一起来看看吧!更多考研资讯请关注我们网站的更新!
长沙理工大学2019考研大纲:833无机化学
一、考试要求
主要考察考生是否掌握了无机化学的基本概念、基本理论和基本方法,以及运用基本理论及应用技术解决实践问题的能力。包括近代物质结构的基础理论,化学热力学、化学平衡、氧化还原等基本原理,重要元素及其化合物的主要性质、结构、用途。主要内容包括热化学,四大平衡,以及原子、分子、固体、配合物结构的基本原理和理论,周期表中s区、p区以及 d区元素及其化合物的组成、结构、性质及其变化规律,f区部分元素的基本性质。
二、考试内容
第一章 气体
理想气体状态方程式及其应用。混合气体中组分气体分压的概念和分压定律。
第二章 热化学
标准摩尔生成焓和标准摩尔燃烧焓的概念。Hess定律。焓变的定量计算;热力学第一定律。
第三章 化学动力学基础
浓度对反应速率的影响和温度对反应速率的影响,活化能、活化分子。速率方程式;Arrhenius方程式及应用
第四章 化学平衡 熵和Gibbs函数
标准平衡常数Kθ及其计算,化学平衡的移动的规律及其有关计算,化学反应进行方向的反应商判据。系统的混乱度,熵的概念,掌握热力学第二定律,热力学第三定律。化学反应等温式ΔrG=ΔrGmө+RTlnJ,Van’t Hoff方程的意义及其相关的计算。平衡常数Kө与吉布斯自由能(ΔrGmө)的关系,ΔrGmө=-RTlnKө,利用公式计算平衡常数Kө或ΔrGmө。利用函数ΔrGmө或ΔrG判断标准态及非标准态下化学反应的方向性。
第五章 酸碱平衡
水的解离平衡、水的离子积常数和强酸、强碱溶液pH值的计算。一元弱酸(碱)的解离平衡及其平衡组成的计算,二元弱酸解离平衡。盐类水解的概念,一元弱酸盐和一元弱碱盐水解平衡及其平衡组成的计算,多元弱酸盐的分步水解及其平衡组成的计算。同离子效应和缓冲溶液的概念,计算缓冲溶液的pH值。配合物的概念,配合物的组成和命名。配合物的稳定常数及配合物在水中的配位平衡,配位平衡的组成的计算。
第六章 沉淀-溶解平衡
难溶电解质的沉淀溶解平衡,溶度积及其与溶解度间的关系和有关计算。溶度积规则。pH值对难溶金属氢氧化物和金属硫化物沉淀溶解平衡的影响及其有关计算。沉淀的配位溶解及其简单计算。分步沉淀,沉淀转化及其简单的计算。
第七章 氧化还原反应 电化学基础
氧化还原反应的基本概念,掌握氧化还原反应的配平。原电池及其电动势的概念,电池符号的书写方法,标准电极电势的概念和应用以及影响电极电位的因素、有关Nester方程式的简单计算。元素电势图及其应用。
第八章 原子结构
原子轨道、几率和几率密度、电子云等概念。四个量子数的名称、符号、取值和意义; s、p、d原子轨道与电子云的形状和空间的伸展方向。原子轨道的近似能级图和原子核外电子排布的规律。常见元素原子的核外电子排布。周期表中元素的分区、结构特征;原子半径、电离能、电子亲合能和电负性的...
09-18
考研大纲频道为大家提供东北林业大学2019自命题科目考研大纲:无机化学,一起来学习一下吧!更多考研资讯请关注我们网站的更新!
东北林业大学2019自命题科目考研大纲:无机化学
考试科目代码:843 考试科目名称:无机化学
考试内容与范围:
一.原子结构和元素周期系
考核知识点
1.基态原子电子组态(电子排布)。
屏蔽与钻穿效应、构造原理、基态原子电子组态。
2.元素周期系及元素周期表。
3.元素周期性:原子半径、电离能、电子亲和能、电负性、氧化态。
考核要求
1.了解核外电子运动的特殊性、原子轨道和电子云的角度分布图与几率的径向分布图。
2.掌握电子云、能级、能级组、电子层的概念以及四个量子数含义并能运用四个量子数描述核外电子运动状态。
3.掌握近似能级图,能按照核外电子排布原理写出一般元素的原子核外电子排布方式与价电子结构式。
4.掌握原子半径、电离势、电子亲和势、电负性及在周期系中的变化规律 。
二.分子结构
考核知识点
1.共价键理论:路易斯结构式、σ 键和π 键。
2.共价分子的性质:共价半径、键能、键长、键角、键的极性与分子的极性。
3.极性分子和非极性分子、偶极矩、分子的磁性。
4.杂化轨道理论(等性与不等性 sp3 、 sp2 、 sp 杂化)。
5.离域π 键。
6.价层电子对互斥理论(VSEPR ) ABn 型分子(离子)构型的判断。
7.分子轨道理论的简介:组成分子轨道的原则、O2、N2、HF分子轨道能级图、分子轨道中的电子排布、键级。
8.等电子体原理。
9.分子间作用力和氢键。
考核要求
1.能写出物质的路易斯结构式。
2.能运用价层电子对互斥理论和等电子体原理推测 ABn 型分子(离子)的价层电子对构型和分子(离子)构型。
3.掌握O2 、 N2 、 HF分子的分子轨道能级图。
4.掌握分子极性、分子间作用力和氢键的概念及对物质物理性质的影响。
5.熟悉杂化轨道理论的要点,掌握杂化类型与分子几何构型的关系。
6.理解物质性质和分子结构间的关系。
7.能运用价键理论分析解决物质的结构与性质关系。
三.晶体结构
考核知识点
1.金属晶体:金属键、金属晶体的堆积模型。
2.离子晶体:离子键、晶格能、离子晶体结构模型。
3.分子晶体与原子晶体
4.离子极化作用和变形性对化学键型及化合物性质的影响。
考核要求
1.掌握晶体的特征、了解几种简单的晶格和离子晶体结构模型。
2.掌握晶格能的意义及其应用。
<...09-13
河北科技师范学院2019年学术学位硕士考研大纲:无机化学已公布,更多考研资讯请关注我们网站的更新!
河北科技师范学院2019年学术学位硕士考研大纲:无机化学
科目名称: 无机化学
本大纲包括参考书目、考试形式和试卷结构、考查范围三部分。
Ⅰ.参考书目
《无机化学》高等教育出版社(第五版) 大连理工大学无机化学教研室编
Ⅱ.考试形式和试卷结构
一、试卷满分及考试时间
本试卷满分为150分,考试时间为180分钟。
二、答题方式
答题方式为闭卷、笔试。
三、试卷题型结构
1、是非判断题20分
2、单项选择题30分
3、配平题9分
4、填空题30分
5、简答题26分
6、计算题35分
Ⅲ.考查范围
第一章 气体
一、理想气体状态方程式
二、气体混合物
第二章 热化学
一、热力学的术语和基本概念
二、热力学第一定律
第三章 化学动力学基础
一、化学反应速率的概念
二、浓度对反应速率的影响——速率方程式
三、温度对速率的影响—Arrhenius方程式
四、反应速率理论
五、催化剂与催化作用
第四章 化学平衡 熵和Gibbs函数
一、标准平衡常数
二、标准平衡常数的应用三、化学平衡的移动
四、自发变化和熵
五、Gibbs函数
第五章 酸碱平衡
一、酸碱质子理论概述
二、水的解离平衡和pH
三、弱酸、弱碱的解离平衡
四、缓冲溶液
五、酸碱指示剂
六、酸碱电子理论与配合物概述
七、配位反应与配位平衡
第六章 沉淀、溶解平衡
一、溶解度和溶度积
二、沉淀的生成和溶解
三、两种沉淀之间的平衡
第七章 氧化还原反应 电化学基础
一、氧化还原反应的基本概念
二、电化学电池
三、电极电势
四、电极电势的应用
第八章 原子结构
一、氢原子结构
二、多电子原子结构
三、元素周期律
无机化学推荐访问